Voyage au coeur des sources hydrothermales
Par Romain Bourboulou
Par Vu Long Tran - Le 7 novembre 2016
Ces dernières années, les nanoparticules ont de plus en plus envahi le monde scientifique, notamment le domaine médical. En effet, ces nanostructures permettent d’envisager de nouveaux espoirs thérapeutiques. Elles sont de plus en plus utilisées en tant qu’agents d’imagerie ou dans le cadre thérapeutique. En ajoutant des ligands spécifiques à leur surface, elles pourront également se déplacer à des endroits ciblés dans notre organisme. Le but de l’utilisation de ces nanoparticules est d’améliorer la thérapie, tout en évitant l’exposition de notre organisme à un risque de toxicité. Certaines nanoparticules sont aujourd’hui développées et modulées pour être utilisées en théranostique, méthode utilisant l’imagerie pour cartographier les sites de maladies cancéreuses afin de les traiter de manière ciblée. Cet article vise à vous présenter ce monde minuscule et le potentiel remarquable des nanoparticules en médecine !
Les nanoparticules d’application biomédicale s’inscrivent dans la nanomédecine, à savoir l’exploitation des nanotechnologies pour le développement de thérapies dans le domaine de la santé. Ces applications novatrices sont possibles grâce à l’exploitation des propriétés physiques, chimiques et biologiques des matériaux à l’échelle nanométrique.
Les nanoparticules biomédicales peuvent être synthétisées à partir de constituants très divers issus soit de sources naturelles, soit de sources synthétiques. Leur taille peut varier de quelques centaines de nanomètres pour les liposomes à un nanomètre dans le cas des nanoparticules d’or. Les nanoparticules présentent de nombreux avantages d’utilisation tels que :
1) La protection de molécules actives fragiles.
2) Le contrôle spatio-temporel de la libération des molécules actives.
3) La capacité de combiner différents éléments dans une seule particule, à savoir :
– soit différentes molécules actives faisant partie d’un cocktail de thérapie.
– soit différents groupements de ciblage des cellules tumorales, tels que des anticorps, des dérivés d’acide folique.
– l’utilisation en tant que sondes d’imagerie : boîtes quantiques (les nano-cristaux des semi-conducteurs pouvant ajuster leur longueur d’onde d’émission de ses fluorescences selon leur composition et/ou leur taille), groupements fluorophores, ou agents de contraste de la Tomographie assistée par ordinateur (IDM) ou de l’Imagerie par Résonance Magnétique (IRM), etc.
Ainsi, étant à la fois des agents d’imagerie, de diagnostic et de thérapie, les nanoparticules offrent des perspectives intéressantes pour la médecine personnalisée.
4) La capacité de cibler spécifiquement les tumeurs cancéreuses grâce à l’effet EPR “Enhanced Permeability and Retention”. Les particules de quelques centaines de nanomètres à quelques nanomètres ont tendance à davantage s’accumuler au niveau des cellules tumorales que dans les tissus sains. Cela se produit en raison de plusieurs phénomènes biologiques dont les deux plus importants sont le développement anormal des vaisseaux sanguins et l’inefficacité du drainage lymphatique dans les tissus cancéreux. Le premier crée de plus larges écarts entre les cellules endothéliales qui autorisent le passage de petites particules. En revanche, le second empêche l’évasion des particules assez grosses de la tumeur. Principalement, ces deux déformations structurales piègent les nanoparticules dans les tissus tumoraux (Figure 1).
5) Des propriétés optiques, thermiques, magnétiques et électroniques exceptionnelles des matériaux grâce à leur taille nanométrique.
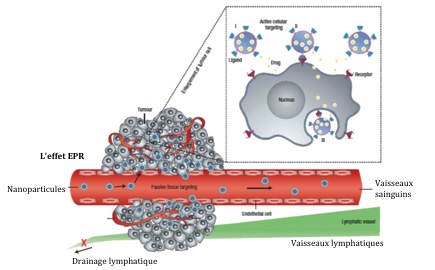
Figure 1. Les mécanismes de ciblage des nanoparticules : ciblage passive avec l’effet EPR et ciblage actif avec les groupes fonctionnalisés. L’image est adaptée de la ref. 7.
Grâce aux propriétés mentionnées ci-dessus, les nanoparticules peuvent avoir plusieurs applications biomédicales. Elles peuvent donc être classées en deux types, en fonction des domaines utilisés : les nouvelles thérapies et les nouvelles solutions diagnostiques en imagerie. Dans les deux cas, la plupart des nanoparticules sont conçues en tant que vecteurs pour protéger et livrer des molécules actives ou des sondes diagnostiques, tels que des micelles, des liposomes, etc.
Les particules fabriquées à partir de métaux nobles ou d’oxydes des métaux peuvent avoir des propriétés intrinsèques en tant qu’agents thérapeutiques ou diagnostiques. Par exemple, les nanoparticules d’or peuvent être utilisées comme des sensibilisateurs en radiothérapie pour améliorer le traitement ou comme des boîtes quantiques en imagerie biomédicale. On utilise essentiellement ces nanoparticules pour cibler le cancer, mais elles peuvent également cibler des marqueurs biologiques de différentes maladies, par exemple, des amyloïdes, les dépôts de protéines insolubles dans les tissus. Ces derniers sont des causes de plusieurs maladies sévères comme la maladie d’Alzheimer, la maladie de Parkinson ou l’athérosclérose (l’épaississement des artères) etc.
Les méthodes de fabrication des nanoparticules varient selon la composition et les propriétés physiques telles que la taille, la forme ou encore les charges de surface que l’on veut obtenir. Cependant, nous pouvons généralement les classifier en deux groupes : l’approche ascendante et l’approche descendante.
L’approche ascendante consiste dans la construction de nanoparticules à partir de petites molécules telles que les molécules amphiphiles – pour les nanoparticules à base de lipides – ou les précurseurs polymériques, etc… Dans le cas de l’approche descendante, le mécanisme met en jeu l’usure d’une grosse structure pour parvenir à de plus petites particules.
Comme dans toute formulation pharmaceutique, il est important de considérer tous les constituants des nanoparticules pour évaluer leur toxicité. En effet, les constituants des nanoparticules pourraient être toxiques en soi. C’est le cas, par exemple, du gadolinium, métal utilisé dans les nanoparticules pour augmenter le contraste en IRM, ou du cadmium et du sélénium utilisés dans les boîtes quantiques. Dans le cas du gadolinium, on doit donc veiller à ne pas en trouver sous forme ionique libre en grande quantité. Ainsi, on utilise des chélateurs spécifiques qui vont fortement encapsuler les ions de gadolinium et éviter un maximum de relargage.
Aussi, les lipides utilisés dans les liposomes pourraient aussi être immunogènes.
D’autre part, la présence dans notre organisme de matières étrangères comme les nanoparticules pourrait provoquer l’adsorption de protéines à leur surface et entraîner des réactions immunitaires. Toutefois, il a été prouvé qu’une couche hydrophile – par exemple de polyéthylène glycol – peut éviter ce phénomène.
Enfin, le profil pharmaco-cinétique, la bio-distribution, le métabolisme et l’excrétion des nanoparticules jouent un rôle crucial dans leur toxicité, en particulier, celle à long terme chez l’homme. Les nanoparticules doivent ainsi être conçues afin d’éviter leur dépôt à long terme dans certains organes : par exemple, un diamètre hydrodynamique (le diamètre de la particule dans le milieu aqueux incluant la couche des molécules d’eau adsorbées sur la surface des particules) inférieur à 6 nm peut assurer une élimination complète des particules par voie rénale et empêcher des accumulations résiduelles dans l’organisme.
En France, c’est l’ANSM – l’Agence Nationale de Sécurité du Médicament et des produits de santé – qui assure la gestion des essais cliniques. Il existe trois groupes de critères principaux qui sont liés aux propriétés physico-chimiques, à la toxicité et à l’efficacité du produit.
Pour les aspects physico-chimiques, il y a des critères communs. D’abord, la structure de la particule doit être bien élucidée et prouvée. La méthode du contrôle de qualité doit être validée. La stabilité du produit final – la poudre de nanoparticules lyophilisées – pendant le stockage doit être strictement suivie. Les impuretés et les produits dégradés doivent être identifiés et prouvés non-toxiques pour l’homme. La nanoparticule doit contenir moins de 0,5% de substances non identifiées. Ensuite, la fabrication, le contrôle de qualité et le stockage doivent respecter les normes de fabrication GMP (Good Manufacturing Practices), GLP (Good Laboratory Practices) et GSP (Good Storage Practices) comme tous les autres produits pharmaceutiques.
Pour prouver l’efficacité du produit, des études précliniques doivent être effectuées. La pharmacologie comprenant la pharmacocinétique, le métabolisme du produit dans le corps humain, et la pharmacodynamique, le mécanisme d’action du produit au niveau cellulaire et moléculaire, doivent être bien déterminés chez au moins deux espèces animales. De même, les études de toxicité doivent être réalisées sur au moins deux espèces animales avant de commencer l’essai clinique. Des études de toxicité in vitro telles que la détermination de la viabilité des cellules traitées avec la particule sont aussi exigées. En plus, il est nécessaire de réaliser des études de carcinogénicité et de toxicité reproductive et développementale.
Au sein de l’Institut Lumière et Matière de Lyon, la nanoparticule AGuIX, une particule à la base de gadolinium, est développée dans le but d’améliorer le traitement du cancer.
La synthèse de la nanoparticule AGuIX se déroule en 5 étapes : le cœur d’oxyde de gadolinium est tout d’abord formé, il sera ensuite enrobé d’une couche de polysiloxane (communément appelé silicone). La prochaine étape consiste dans la greffe des ligands comme le DOTAGA qui vont chélater (emprisonner) les ions gadolinium pour qu’ils ne soient pas à l’état libre dans l’organisme. On transfère alors le produit de synthèse dans l’eau, ce qui va provoquer la dissolution du cœur et ensuite, la fragmentation de la couche polysiloxane. On obtient alors les nanoparticules. Cette synthèse est un procédé original mais compliqué : il est résumé dans le schéma ci-dessous.

Figure 2. La synthèse des nanoparticules. Image dessinée par l’auteur.
Premièrement, comme vous le savez, la radiothérapie – une méthode thérapeutique qui vise à détruire les cellules tumorales en utilisant des rayonnements ionisants – est l’une des méthodes les plus répandues pour traiter le cancer. Cependant, malgré les améliorations dans l’ajustement du faisceau et la planification des traitements, cette technique ne tue pas seulement les cellules cancéreuses, mais va aussi endommager les cellules saines voisines. En agissant en tant que sensibilisateur, AGuIX limite cet effet et améliore la fenêtre thérapeutique c’est-à-dire le seuil de l’administration du rayonnement pour éviter des dommages au niveau de l’organisme. En effet, après avoir été injecté, AGuIX est plus favorablement distribué dans les tissus cancéreux que dans les tissus sains grâce à l’effet EPR. Ensuite, l’atome de gadolinium (élément lourd) présent dans les particules va augmenter l’absorption du faisceau sur les tissus ciblés par les particules. Par conséquent, AGuIX peut contribuer à l’amélioration des effets thérapeutiques à une dose d’irradiation plus faible.

Figure 3. La radiothérapie dans le cerveau avec la présence de l’AGuIX. Image adaptée de la ref. 5
De nombreuses nanoparticules ont une application similaire à celle de l’AGuIX, mais cette dernière présente des propriétés uniques.
– Le gadolinium présent dans AGuIX est l’agent de contraste le plus efficace pour l’IRM. De plus, la fonctionnalisation des nanoparticules par plusieurs molécules organiques ou l’incorporation de radio-isotopes pour la radio imagerie est très facile car la stabilité de la particule lui permet de s’engager dans plusieurs réactions chimiques.
Cela permet d’obtenir un médicament de théranostique, qui va permettre la visualisation et le traitement de tissus cancéreux via le même agent et parfois simultanément quand les équipements sont disponibles, et un agent d’imagerie multimodale permettant de combiner différentes techniques d’imagerie telles que l’IRM, la radio imagerie et l’imagerie optique.
– De plus, tous les composants de la nanoparticule ont un niveau de toxicité très faible et sa taille – moins de 6 nm – lui permet d’être excrétée rapidement par les voies urinaires et ainsi éviter le dépôt à long terme du gadolinium dans le corps.
Bien que cette technologie soit très prometteuse, quelques limites existent. Par exemple, la synthèse de cette particule est assez compliquée et présente un rendement faible, ce qui augmente le coût de fabrication du produit. Des études sont en cours pour simplifier le processus de synthèse.
AGuIX a été contrôlé de la même manière que les nanomédicaments. Les critères physico-chimiques ont été remplis : l’information sur la structure et la synthèse de cette particule a été fournie. Les techniques chromatographiques de contrôle de qualité ont été validées. La stabilité dans différentes conditions de stockage, les impuretés et les produits dégradés ont été étudiés. En ce qui concerne la fabrication, un lot clinique de l’AGuIX a été synthétisé par une usine GMP en Suisse.
Les études de toxicologie ont été réalisées sur les rats et les singes. Les études de toxicologie in vitro ont aussi été effectuées. De plus, plusieurs expériences de radiosensibilisation avec différents modèles des cellules, des souris et des rats pour les cancers du cerveau, de la peau, du pancréas, des voies aérodigestives supérieures et du poumon ont été réalisées. Le profil pharmacologique de AGuIX chez des rongeurs et des singes a été validé. Jusqu’à présent, le laboratoire ILM à Lyon a obtenu une autorisation pour démarrer les essais cliniques à Grenoble sur un premier lot de l’AGuIX.
Dans un avenir proche, après les essais cliniques chez l’homme, plusieurs efforts seront faits pour l’utilisation de l’AGuIX dans un contexte clinique. Les études précliniques sur différents modèles animaux seront poursuivies en vue de découvrir d’autres applications potentielles de l’AGuIX. Des projets sont consacrés à l’amélioration du protocole de synthèse et à la conception de nouvelles nanoparticules à partir de la particule de l’AGuIX standard. Ainsi, de nouvelles modalités d’imagerie ainsi que de nouvelles approches de couplage aux principes actifs sont actuellement à l’étude, l’objectif étant d’améliorer le ciblage actif de certaines tumeurs. En outre, un spray nasal sera développé en tant que nouvelle voie d’administration du traitement pour le cancer du poumon.
Vu Long Tran est pharmacien au Vietnam. Après avoir obtenu son diplôme, il a travaillé dans une société pharmaceutique en tant que formulateur. Ensuite, il a rejoint le Laboratoire de Délivrance de Cellules et Macromolécules à l’Université Nationale de Séoul, en Corée du Sud, pendant une brève période avant de s’installer en France pour effectuer un master en photonique appliquée à la biologie et à la chimie (MONABIPHOT) à l’ENS Cachan. Il est actuellement doctorant dans l’équipe de Pr. Olivier Tillement à l’Institut Lumière et Matière, l’Université Claude Bernard Lyon I, France.
Son projet de recherche consiste dans le développement d’une voie de synthèse efficace de l’AGuIX, une nanoparticule développée et potentiellement utilisée dans le traitement de cancer. Ce projet est financé par l’ARGENT (http://itn-argent.eu/), le projet européen Marie Curie, qui soutient la collaboration entre des groupes de recherche multidisciplinaires situés dans différents pays en Europe. Le but de ce projet est d’explorer des solutions à l’échelle nanométrique pour la radiothérapie dans le traitement de cancer.
Toi aussi participe au blog !
ParticiperPar Romain Bourboulou
Par Julie Suzialuk
Par Karine Da Silva Lages
Par Pauline Granger