[Podcast] L’ingénierie tissulaire au service de la régénération osseuse
Par Romain Durand-de Cuttoli
Par Romain Durand-de Cuttoli - Le 20 août 2014
Il est de ces avancées de la médecine et, de manière plus générale, de la science qui peuvent paraître incroyables et fabuleuses. Des recherches récentes sur les cellules souches laissent entrevoir de belles perspectives pour la transplantation cardiaque.
Une équipe de médecine régénératrice du Texas Heart Institute dirigée par le docteur Doris Taylor développe actuellement une technique qui pourrait bien révolutionner le monde de la chirurgie cardiaque d’ici quelques années. Cette technique consiste à faire « pousser » un coeur humain à partir des cellules souches du patient via une matrice appelée « organe fantôme »!
Un coeur humain est constitué de près de 3 milliards de cellules qui ont la capacité de se contracter pour envoyer chaque jour environ 7 000 litres de sang vers tout l’organisme via près de 200 000 km de vaisseaux! Cette « machinerie » fascine par la qualité de son organisation et la régularité de son activité tout au long de la vie. Elle présente cependant un défaut : en cas de défaillance, par exemple une nécrose des cellules du myocarde suite à un infarctus, le coeur ne peut pas s’auto-réparer de manière efficace. Lorsque les dégâts sont massifs et que l’âge et l’état général du patient le permettent, on propose d’effectuer une transplantation cardiaque qui consiste à remplacer le coeur endommagé par celui d’un donneur compatible. Cependant, une des difficultés majeures pour les patients en attente d’une greffe est celui de la disponibilité des organes compatibles et des listes d’attente interminables. En matière d’organes, la demande est nettement supérieure à l’offre.
Certaines initiatives tentent de pallier à ces difficultés. Par exemple, la prothèse cardiaque entièrement artificielle développée en France par la société Carmat, implantée pour la première fois chez un patient avec succès en 2014 à l’hôpital européen Georges Pompidou à Paris, offre un nouvel espoir.
Écouter le podcast d’Indésciences à ce propos, interview du chirurgien Christian Latrémouille.
Des cellules souches (et une technique originale) pour « faire pousser » un coeur humain?
L’équipe de Doris Taylor propose, quant à elle, de recréer un coeur humain fonctionnel à partir des cellules souches du patient. Le défi peut paraître incroyable, et pourtant, les premiers éléments de leurs études semblent indiquer la faisabilité de cette technique.
Si sur le papier la recette pour recréer un coeur humain fonctionnel parait assez simple, cette technique est en proie à d’immenses défis. Alors que le médecine régénératrice a d’ores-et-déjà connu certains succès pour le remplacement de structures tubulaires comme des trachées, des oesophages ou encore des vaisseaux sanguins, son application pour des organes plus complexes tels que le rein, le foie ou le coeur (les trois organes les plus demandés en vue d’une transplantation) semble bien plus délicate. En effet, créer un coeur consiste à assembler des dizaines de types cellulaires correctement, de retrouver une vascularisation compatible avec la survie et la croissance de l’organe. Enfin et surtout ce dernier doit être fonctionnel et idéalement pour la durée d’une vie entière.
Le protocole décrit par l’équipe nécessite de réunir trois éléments indispensables à la « fabrication » de ce coeur : dans un premier temps un squelette qui servira de support à la croissance de l’organe, puis de le remplir de cellules vivantes et enfin d’apporter la fonction en permettant le battement régulier et automatique.
Un coeur « fantôme » comme matrice
Alors que depuis quelques années l’impression 3D a ouvert des pistes incroyables pour la création de structures biologiques artificielles relativement simples telles que des trachées ou des vessies, à l’heure actuelle aucune machine ne permet de créer une structure aussi complexe que la matrice d’un coeur humain. Le meilleur moyen d’y parvenir est donc d’emprunter à la nature ce qu’elle a créé.
Et le principe est le suivant : à partir d’un coeur de porc, on élimine toute les cellules cardiaques, les lipides, les acides nucléiques, les glucides et les protéines solubles avec un traitement par des détergents chimiques, ce qui permet de ne conserver que les protéines de structure (collagènes, laminines, etc.) et ainsi d’obtenir le « squelette » d’un coeur. Cette étape nécessite une maîtrise parfaite du protocole : la concentration du détergent, le débit de circulation dans l’organe, ou encore le temps d’exposition sont autant de facteurs qui jouent sur une « décellularisation » optimale de l’organe. Cette première étape est à l’heure actuelle celle qui est la mieux maîtrisée. Une fois ce support créé ( Fig. 1), il faut le remplir avec des cellules vivantes.
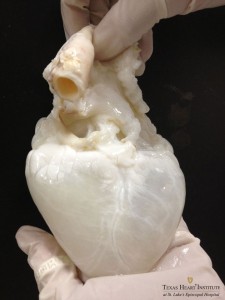
Figure 1 : Cette matrice, composée uniquement des protéines de structure après un lavage par des détergents va servir de squelette pour la croissance du nouvel organe. (Doris Taylor, Texas Heart Institute)
La phase de “recellularisation”
Les cardiomyocytes adultes ne peuvent proliférer. Si tel était le cas, les recherches du Dr Taylor seraient inutiles, un coeur endommagé pourrait s’auto-réparer. Il faut donc déterminer quelles sont les cellules souches les plus adaptées dans ce contexte (cellules embryonnaires ou cellules pluripotentes de la moelle osseuse?) et dans quelles quantités pour reconstruire un coeur fonctionnel.
La stratégie adoptée est d’injecter des cellules précurseurs de l’endothélium dans les vaisseaux du coeur « fantôme » et des cellules précurseurs de cardiomyocytes dans l’espace qui sera occupé par le muscle cardiaque à proprement parler. On notera que ces cellules étant issues du patient lui-même, les problèmes liés au rejet seront de fait moindres.
Afin que le développement du tissu se fasse correctement, il faut recréer des conditions proches de la physiologie. Pour cela, le coeur en développement est placé dans un bio-réacteur qui permet d’une part d’apporter l’oxygène, les nutriments et les facteurs de croissances nécessaires mais aussi de recréer les conditions environnementales (température, pH) et mécaniques (pression, mouvements de contraction) indispensables à l’émergence de la fonction. Le bio-réacteur utilisé par l’équipe permet ainsi de recréer artificiellement des conditions physiologiques et notamment de mimer mécaniquement le battement synchrone des cellules à l’aide de stimulations électriques. Bien sûr, un tel bio-réacteur ne permet pas pour l’heure d’imiter totalement le développement d’un coeur humain, notamment compte-tenu du nombre de cellules qui le composent. Cependant, une étude publiée en 2008 par l’équipe du Dr Taylor, montre qu’une telle méthode a permis de recréer pour un coeur de rat un battement autonome correspondant à 2% de la capacité physiologique. Des données non publiées actuellement de l’équipe suggèrent que depuis, ils ont réussi à atteindre un rendement de 25%.
La dernière problématique et non des moindres reste à implanter un tel organe chez un être vivant qui soit capable d’en assumer la fonction d’un coeur physiologique : celle du battement automatique, régulier et adapté à l’effort. Au delà du challenge que représente la chirurgie en elle-même, il faudra attendre que l’équipe du Dr Taylor réussisse à recréer des coeurs pour des espèces de plus grandes tailles et avec un rendement meilleur, approchant les capacités fonctionnelles d’un coeur physiologique.
Les premiers éléments de ces études demeurent très prometteurs, et bien que les avancées se fassent par étapes modestes, les personnes qui défendent ce projet restent très confiantes sur le choix des stratégies employées.
Ott, H. C. et al. Perfusion-decellularized matrix: using nature’s plateform to engineer a bioartificial heart. Nature Med. 14, 213–221 (2008).
Zopf, D. A., Hollister, S. J., Nelson, M. E., Ohye, R. G. & Green, G. E. Bioresorbable Airway Splint Created with a Three-Dimensional Printer N. Engl. J. Med. 368, 2043–2045 (2013).
Crédits photo de couverture : Dominique Cappronier via Flickr
Toi aussi participe au blog !
ParticiperPar Romain Durand-de Cuttoli
Par Mélissa COURT
Par Joachim Bellet
Par SAADALLAH Khansa